(Опубликовано в журнале «Ветеринария» 2015 №11. С.17-21)
Изучали действие полипренилфосфата натрия (ППФН) на вирус ринотрахеита кошек invitro и invivo. Препарат в дозе 200 мкг/мл подавляет репродукцию агента в перевиваемой линии клеток CFRK. При применении экспериментально зараженным кошкам он достоверно повышает их выживаемость, снижает сроки выздоровления и тяжесть болезни, способствует достоверному повышению титра вируснейтрализующих антител. Сделанные наблюдения открывают широкие перспективы использования фосфорилированных полипренолов для лечения животных при герпесвирусных инфекциях.
Ключевые слова : герпесвирусный ринотрахеит кошек, полипренилфосфат, противовирусная активность.
Инфекционный (герпесвирусный) ринотрахеит и калицивироз – важнейшие компоненты «комплекса респираторных болезней кошек», который также включает реовирусные, хламидийные, микоплазменные и некоторые другие инфекции. У заболевших животных нередко диагностируют смешанное течение ринотрахеита и калицивироза. При отсутствии надлежащего лечения «комплекс респираторных болезней» кошек завершается летальным исходом приблизительно в 20 % случаев. Особую угрозу он представляет для котят в возрасте до 6 месяцев. В связи с этим поиск эффективных средств этиотропной терапии животных представляется актуальной задачей.
Цель работы – оценить эффективность полипренилфосфата натрия (ППФН) растительного происхождения при экспериментальной герпесвирусной инфекции в культуре клеток и у котят.
Материалы и методы. Испытывали 0,4%-ный раствор ППФН производства ООО «Гамасинтез» (Москва).
Штамм Гранд вируса инфекционного ринотрахеита (ИРТ) с активностью 6,5 lg ТЦД 50/мл репродуцировали в перевиваемой линии клеток почки кошки CFRK. Их, а также гипериммунную поликлональную сыворотку, полученную от переболевших инфекционным ринотрахеитом кошек, получили в ВГНКИ ветпрепаратов.
В эксперименте in vitro трехдневную культуру клеток CFRK в стандартных культуральных флаконах (S = 25см2) заражали вирусом ИРТ в дозе »5 –10 БОЕ/кл. Оставляли на 1,5 ч при 37 0С для адсорбции клеток с вирусом, затем во флаконы вносили по 2 мл среды для мечения, включавшей: 3 мл раствора Эрла с 200 мкг/мл ППФН, 3 мл двойной МЕМ, 21 мкл 35S-меченного метионина. Через 24 ч в культуры добавили по 400 мкл РИП-буферного раствора (10 мМ трис-HCl, рН 8,0; 0,13 М NaCl; 1 мМ ЭДТА; 1%-ный NP-40; 500 ед./мл апротинина; 1 мМ ПМСФ) и подвергли их 3-кратному замораживанию (при минус 70 0С) и оттаиванию. Лизат 2-кратно в течение 20 мин осветлили центрифугированием при14 тыс. об./мин. Аликвоты супернатанта (180 мкл) собирали в микропробирки с 10 мкл поливалентной сыворотки к вирусу ИРТ. Смесь выдерживали 12 ч в холодильнике при 4 0С. Одновременно протеин А- сефарозу (ПАС) оставляли для набухания в РИП-буферном растворе (в объемном соотношении 1:1). На следующий день ПАС трехкратно промывали равным объемом буферного раствора РИП. Осадок ресуспендировали в равном объеме последнего и добавляли по 50 мкл взвеси в аликвоты супернатанта с последующим 2-часовым инкубированием смеси при комнатной температуре в условиях встряхивая с интервалом 20 мин. Затем пробы центрифугировали 10 мин при 6000 об/мин, промывали 5 раз 1 мл буферного раствора W (10 мМ трис-HCl, рН 8,0; 0,15 М NaCl; 1 мМ ЭДТА; 0, 01%-ный NP-40) и смешивали с 20 мкл S-буфера для нанесения на гель (0,0625 М трис-HCl, рН 6,8; 20 % глицерина; 10 % b-меркаптоэтанола; 2 % додецилсульфата натрия; бромфеноловый синий на кончике шпателя). После прогревания их в течение 10 мин при 95 0С, пробы оставляли на 12 ч в холодильнике при 4 0С. На следующий день проводили гель-электрофорез в денатурирующих условиях (1% додецилсульфата натрия) по Лэммли в 10%-ном полиакриламидном геле (ПААГ). Вместе с пробами в одну дорожку помещали маркеры молекулярной массы – смесь № 4 (Pharmacia, Швеция) следующего состава: фосфорилаза ( 94 000 Да), БСА (67 000 Да), овальбумин ( 43 000 Да), карбоновая ангидраза (30 000 Да), ингибитор трипсина (20 000 Да), L-лактоальбумин (14 000 Да). Разделение заканчивали в момент выхода из геля бромфенолового синего. Гели фиксировали 1 ч в водном растворе, содержавшем 96%-ного этанол (10%) и ледяную уксусную кислоту (20%). После промывания водой (до исчезновения запаха уксусной кислоты) гели 2 ч окрашивали Кумасси R-250, промывали в растворе, содержавшем 25 % этилового спирта и 7 % уксусной кислоты, 4 раза по 20 мин обрабатывали безводным диметилсульфоксидом и инкубировали 1 ч при 20 0С в 20%-ном растворе сцинтиллятора (PPO) в диметилсульфоксиде. После 30-минутного нахождения в вакуумной сушке при 80 0С сухие пластины гелей выдерживали в рентгенографической кассете с пленкой Kodak 10 суток в холодильной камере при минус 70 0С.
Исследования invivo проводили на 39 беспородных котятах в возрасте 1,5 – 2 мес. До и после заражения вирусом ИРТ у них брали пробы крови для определения титра вируснейтрализующих антител, смывы с конъюнктивы глаз для тестирования в ПЦР и фекалии для электронно-микроскопического анализа.
Котятам перорально и интраназально инокулировали по 0,5 мл взвеси вируса ИРТ с титром 10 5,5 ТЦД50/мл. За животными наблюдали и при появлении первых признаков заболевания их разделили на 2 группы (опытную и контрольную), которые содержали в разных помещениях.
Котят опытной группы (n=22) лечили ППФН (орошением слизистой оболочки ротовой полости в дозе 4 мг/кг массы тела 2 раза в сутки) и средствами симптоматической терапии (бициллин-3, гамавит, пиобактериофаг, а в случаях интенсивного обезвоживания организма – вводили физиологический раствор с 5% глюкозы).
Контрольную группу заболевших котят (n=17) разделили на две подгруппы: первую (13 котят, которых не лечили) и вторую (4 животных, которым применили средства симптоматической терапии).
Активность ППФН при ИРТ оценивали по следующим показателям:
- средней гармонической величине времени жизни (τ) котят каждой группы, включающей информацию обо всех подопытных, которую вычисляли по формуле: 1/τ = (X 1/t1+ X2/t2+ … + Xn/tn):n,
где t – день гибели животных, Х – количество погибших особей в день t, n –число животных в группе;
- кратность защиты (КЗ) – кратность уменьшения количества заболевания и падежа в опытной группе по сравнению с контрольной, которую вычисляли по формуле: КЗ= % павших в контроле/5 павших в опыте;
- индекс эффективности препарата (ИЭ), определявшийся по формуле: ИЭ%= [(КЗ-1)/КЗ] х100.
В процессе эксперимента у котят на протяжении 3 – 5 недель измеряли температуру тела, взвешивали, регистрируя результаты наблюдений за животными и оценивая их клиническое состояние в баллах (табл. 1).
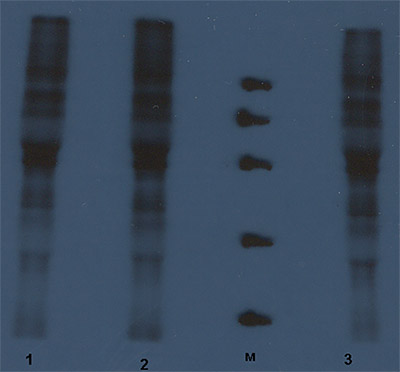
Результаты исследований и обсуждение. Радиоавтография лизированных клеток с поликлональной сывороткой кошек против вируса ИРТ показала, что ППФН в дозе 200 мкг/мл подавляет накопление белков возбудителя в чувствительной культуре клеток CFRK (рис. 1).
В таблице 1 представлены данные, характеризующие клиническое состояние экспериментально зараженных вирусом ИРТ котят.
Рис 1. Влияние ППФН на созревание белков вируса ИРТ в чувствительной культуре клеток CFRK через 24 ч после ее заражения; белки на дорожках: 1 – в незараженных клетках; 2 – в клетках, инфицированных вирусом ИРТ без добавления ППФН; м – маркер молекулярной массы; 3– в клетках, инфицированных вирусом ИРТ в присутствии ППФН (200 мкг/мл)
Таблица 1
Оценка состояния котят по клиническим симптомам на всех этапах эксперимента
|
Симптомы |
Тяжесть, баллы |
|||
|
0 |
1 |
2 |
3 |
|
|
Внешний вид |
Норма |
Слабая депрессия |
Умеренная депрессия |
Сильная депрессия |
|
Температура, 0С |
37,7 – 39,2 |
> 39,2 – 39,7 |
>39,7 – 40,3 |
> 40,3 или < 37,7 |
|
Выделения из носа |
Нет |
Слабые серозные |
Умеренные слизистые |
Обильные гнойно-слизистые |
|
Выделения из глаз |
Нет |
Слабые серозные |
Умеренные слизистые |
Обильные гнойно-слизистые |
|
Язвы слизистой ротовой полости |
Нет |
Одна небольшая |
Несколько небольших |
Многочисленные или большие |
До заражения вирусом ИРТ у котят обнаружили калицивирус в 6 и парвовирус в 8 случаях. Таким образом, несмотря на то, что подопытных животных инфицировали только возбудителем ИТР, у некоторых особей наблюдали смешанные инфекции, что соответствовало клиническому их состоянию (таблица 2).
Таблица 2
Обнаружение вирусов у котят в ПЦР, с помощью электронной микроскопии и посредством изоляции в культуре клеток
|
Группа |
Число котят |
Количество инфицированных котят |
||||||||
|
до заражения |
после заражения |
после выздоровления |
||||||||
|
ГВ |
КВ |
ПВ |
ГВ |
КВ |
ПВ |
ГВ |
КВ |
ПВ |
||
|
Контрольная |
17 |
0 |
2 |
3 |
17 |
2 |
3 |
1 |
2 |
3 |
|
Опытная |
22 |
0 |
4 |
5 |
22 |
4 |
5 |
2* |
0 |
0 |
Примечание . ГВ – герпесвирус; КВ – калицивирус; ПВ – парвовирус; * выявление у этих животных нуклеокапсида герпесвируса, вероятно, служит подтверждением хронического носительства агента.
В первой контрольной подгруппе на 3 – 4-е сутки после заражения герпесвирусом погибло 9 котят. Выжившие животные продолжали болеть (общая слабость, единичные язвочки в ротовой полости, чихание, выделения из глаз и носа) и оставались вирусоносителями, о чем свидетельствовали результаты диагностических исследований (электронной микроскопии, ПЦР, изоляции вирусов из взятого от них патологического материала в культуре клеток CFK). Несмотря на проведенное симптоматическое лечение, во второй контрольной подгруппе погибли 3 из 4 котят.
22 котенка опытной группы, заболевшие на 2 – 3-е сутки после заражения вирусом ринотрахеитом, лечили с использованием ППФН. Из них 18 особей выздоровели на 4 – 5-е, а остальные 4 – на 7 – 9-е сутки. Большие сроки выздоровления последних были, по-видимому, обусловлены наличием у них смешанной инфекции герпесвируса, калицивируса и парвовируса кошек. Несмотря на клиническое выздоровление, у 2-х животных методом электронной микроскопии обнаружили герпесвирус, что могло свидетельствовать о хроническом носительстве агента.
Увеличение средней гармонической продолжительности жизни с 1,97 дней в контрольной группе до 35,5 дней в опытной, а также высокий коэффициент защиты (6,55) и индекс эффективности (84,7%) в опытной группе также подтверждают активность ППФН при данной инфекции.
У всех экспериментально зараженных вирусом ИРТ котят, которых лечили ППФН, уровень гуморального иммунитета достоверно повысился с 4,45 ± 0,36 до 6,87 ± 0,52 log 2 (Р<0,01). В то же время в контрольной группе, в которой препарат не применяли, отсутствовал достоверный прирост титра вируснейтрализующих антител (5,87 ± 0,90 против 6,3 ± 0,85 log 2, Р>0,05). Полученные данные свидетельствуют об иммуностимулирующем действии ППФН.
Препараты на основе фосфорилированных полипренолов растительного происхождения подавляют в культурах клеток размножение вирусов клещевого энцефалита, энцефаломиелита Тейлера, желтой лихорадки, вирусной диареи – болезни слизистых оболочек и инфекционного ринотрахеита крупного рогатого скота [1, 3, 6]. Они пригодны для лечения и профилактики при чуме плотоядных, герпесвирозе, аденовирозах, парагриппе и папилломатозе собак [2, 9, 10, 11], инфекционном перитоните кошек [7, 12], в экспериментальных условиях – при болезни Ауески [4]. В некоторых случаях эти препараты проявляли прямое противовирусное действие [3, 6], но такой эффект мог быть результатом активации некоторых звеньев врожденного иммунитета (синтеза интерферона и ряда других цитокинов, макрофагов и естественных киллерных клеток), обеспечивающих повышение неспецифической резистентности организма животных [1, 5, 8 ]. В настоящей работе показано, что влияние ППФН на вирус герпеса invitro связано с подавлением созревания белков возбудителя в клетках. В условиях экспериментального заражении вирусом ИРТ установили, что ППФН значительно повышает выживаемость котят, снижает тяжесть заболевания, сокращает сроки выздоровления, а также способствует росту титра вируснейтрализующих антител. Таким образом, полипренилфосфат натрия, который является действующим началом фоспренила, гамапрена и фортепрена, можно рекомендовать для лечения кошек при вирусном ринотрахеите.
Заключение. Полипренилфосфат натрия в дозе 200 мкг/мл подавляет накопление белков вируса ИРТ в чувствительной культуре клеток CFRK. Он
достоверно повышает выживаемость кошек при экспериментальном заражении вирусом ИРТ и снижает тяжесть заболевания. При лечении котят от герпесвирусной инфекции полипренилфосфат натрия сокращает срок выздоровления до 4 – 5 суток, а у животных со смешанным типом инфекции до 7 – 9 суток, он также способствует достоверному повышению титра вируснейтрализующих антител.
Experimental study of sodium polyprenyl phosphatis antiviral effect against feline infectious rhinotracheitis virus in vitro and in vivo
A.V. Sanin, A.V. Pronin, А.N. Narovlyansky, T.N. Stepanova, S.L. Savoyskaya, I.K. Zubashev, E.I. Elisbarashvili, E.A. Bakulina, N.V. Vyshivkina, S.V. Ozherelkov
Authors studied the effect of sodium polyprenyl phosphatis (SPP) on feline rhinotracheitis virus in vitro and in vivo. The drug at a dose of 200 mcg/ml inhibits reproduction of the virus in cell line CFRK. Its application to experimentally infected cats significantly increases their survival, reduces recovery time and severity of the disease, contributes to a significant increase of titer virus neutralizing antibodies. These observations open up broad prospects for the use of phosphorylated polyprenols for the treatment of herpesvirus infections.
Key words: feline herpesvirus rhinotracheitis, sodium polyprenyl phosphatis, antiviral activity.
Авторы:
Александр Владимирович Санин, д.б.н., профессор
Александр Васильевич Пронин, д.б.н., профессор, заместитель директора
Александр Наумович Наровлянский, д.б.н., профессор
Татьяна Николаевна Степанова, к.б.н., старший научный сотрудник
Светлана Леонидовна Савойская, к.б.н., старший научный сотрудник
Игорь Константинович Зубашев, к.б.н., старший научный сотрудник
ФГБУ Федеральный научно-исследовательский центр эпидемиологии и микробиологии имени Н.Ф. Гамалеи Минздрава РФ
Элизбар Иосифович Элизбарашвили, к.б.н. ведущий научный сотрудник
ФГБУ «ВГНКИ»
Елена Александровна Бакулина, ветеринарный врач
Нина Васильевна Вышивкина, ветеринарный врач
Ветеринарная клиника «Орикс»
Сергей Викторович Ожерелков, д.б.н., профессор
Институт полиомиелита и вирусных энцефалитов им. М.П. Чумакова РАМН
Литература
1. Васильев А.Н., Ожерелков С.В., Козлов В.В. и др. Противовирусная и иммуномодулирующая активность полипренилфосфатов при вирусных инфекциях. Антибиотики и химиотерапия. 2008; 53:3 – 8.
2. Гордеева Е.В., Васильев И.К., Наровлянский А.Н. и др. Папилломатоз ротовой полости собак – новый подход к лечению. Росcийский ветеринарный журнал. 2008; 2:15 – 17.
3. Кожевникова Т.Н., Викторова Е.Г., Козлов В.Г. и др. Морапренилфосфаты подавляют размножение вируса энцефаломиелита Тейлера и накопление вирусного белка VP3 в чувствительных культурах клеток BHK-21 и P388D1. Микробиология. 2007; 3: 26 – 30.
4. Наровлянский А.Н., Ожерелков С.В., Санин А.В. и др. Противовирусная активность и возможные механизмы действия морапренилфосфатов при экспериментальной инфекции, вызванной вирусом простого герпеса 1 типа. Микробиология. 2014; 5:54 – 60.
5. Наровлянский А.Н., Парфенова Т.М., Васильев А.Н. Фортепрен – новый перспективный антигерпесный препарат на основе полипренилфосфатов. Матер. объед. иммунол. форум СпБ 30.06- 5.07 2008 г. Российский иммунологический журнал. 2008; 2(11), 2 – 3:256.
6. Ожерелков С.В., Белоусова Р.В., Данилов Л.Л. и др. Препарат фоспренил подавляет размножение вирусов диареи и инфекционного ринотрахеита крупного рогатого скота в чувствительных культурах клеток. Вопросы вирусологии. 2001; 5:43 – 45.
7. Переслегина И.О., Виденина А.А., Наровлянский А.Н. Новое в лечении кошачьего инфекционного перитонита. Российский ветеринарный журнал. 2013; 1:6 – 10.
8. Пронин А.В., Ожерелков С.В., Деева А.В. Полипренилфосфаты как адъюванты, поляризующие иммунный ответ в сторону Th1. Инфекция и иммунитет. 2012; 2(3):645 – 650.
9. Санин А.В., Савойская С.Л., Васильев И.К. Применение Гамапрена при лечении вирусных инфекций у кошек. Ветеринария Кубани. 2009; 6:29 – 30.
10. Санин А.В. Применение иммуномодуляторов при вирусных заболеваниях мелких домашних животных. Российский ветеринарный журнал. 2005; 1:38 – 42.
11. Савойская С.Л., Клицунова Н.В., Наровлянский А.Н. Эффективность препарата Гамапрен при лечении аденовироза и парагриппа собак. Ветеринарный доктор. 2008; 11:15 – 16.
12. Фурман И.М., Васильев И.К., Наровлянский А.Н. Применение препаратов на основе растительных полипренолов при различных формах кошачьего инфекционного перитонита. Российский ветеринарный журнал. 2010; 3:42, 43.